今回の記事では、大学無機化学に登場する「標準酸化還元電位」について具体的な問題を解きながら、解説していきます。高校化学より、難しい代わりに、ワンパターンで酸化還元について理解できる概念です。
この記事を読んで、以下のことを理解できればOKです↓↓
①高校:イオン化傾向⇒大学:標準酸化還元電位
②標準酸化還元電位を用いた、反応の予測
今は、「標準酸化還元電位」ってなんやねん状態なので、わからなくて大丈夫です。これから丁寧に説明していきます。それでは頑張っていきましょう!
酸化還元の復習
まずは高校でやった酸化還元の復習をしましょう。(飛ばしても大丈夫です)
①A→A⁺+e⁻(酸化される=還元剤)
②B+e⁻→B⁻(還元される=酸化剤)
➂2つの反応のうちどちらが酸化or還元かはイオン化傾向をもとに判断する
反応が難しい場合、単純に右辺に電子があるとき酸化される、左辺に電子があるとき還元されるとだけ覚えておけばとりあえずは大丈夫です。
酸化還元反応は必ずペアで起きます。「酸化だけが」または「還元だけが」起きるということはありえません。
①A→A⁺+e⁻(酸化される=還元剤)
②B+e⁻→B⁻(還元される=酸化剤)
①、②の反応から、電子の授受によって反応が起きていることがわかります。酸化されるということは電子を奪われることであり、還元されるとは電子をもらうことです。
ここで最も単純な亜鉛板を硫酸銅(Ⅱ)水溶液に入れたときの反応を考えます。
高校化学を学んでいるあなたであれば、すんなり以下のように反応式を書けると思います。

さて、もはや無意識に上記の反応を書いていると思いますが、なぜこのような反応式を書いたのでしょうか?それは、あなたの頭にイオン化傾向の知識が入っているからです。
水溶液中の金属元素の陽イオンのなりやすさ
Li>K>…>Mg>Al>Zn>Fe>…>Cu>…>Au
このイオン化傾向からZn>Cuのため、亜鉛がイオンになりやすいことを知っているから、反応式が書けたということです。
高校での酸化還元の復習は以上です。
標準酸化還元電位
ここから、大学の分野に一歩踏み込みます。まずは、結論からどうぞ
①半反応を左から右へ進ませる力
②標準酸化還元電位が大きいほど、左から右に進む
➂標準酸化還元電位の値E゜は与えられる。(暗記不要)
※➂のお約束があるので、これ以降に出てくる標準酸化還元電位の値E゜がどこから出てきたんだ?と困惑しなくて大丈夫です。私も調べたうえで書いているので、覚えているわけではありません。おそらくあなたが学習している教科書には標準酸化還元電位の一覧表が掲載されていると思います。
ここで、すぐ標準酸化還元電位の問題を解きたいところですが、超超超重要なルールが2つあるので、そこだけ押さえましょう。
(1)どの反応であっても電子は左辺に置くこと。
(2)E゜大が左辺、E゜小が右辺に物質が存在する必要がある(条件)
※物質が存在しないと反応が起こらない
ルールは問題を解くうちに慣れますので、次にいきましょう。
では、先ほどの「イオン化傾向」で考えた亜鉛版と硫酸銅(Ⅱ)の反応を標準酸化還元電位を使って、考えてみましょう。
Zn²⁺+2e⁻⇄Zn E゜=ー0.76V
Cu²⁺+2e⁻⇄Cu E゜=+0.34V
標準酸化還元電位(以降はE゜のみ)は上記のように、与えられます。

ルール(1)に従って、どちらの半反応式も電子を左辺に置いています。ここで、E゜は「①半反応を左から右へ進ませる力」かつ「②標準酸化還元電位が大きいほど、左から右に進む」でしたので、銅の半反応式が右から左に進行します。酸化還元反応は、必ずペアで進行するので、亜鉛の半反応式は仕方なく左から右に進行します。最後にルール(2)E゜大が左辺、E゜小が右辺に物質が存在する必要があるという条件をクリアしているかを確かめます。確かに、E゜大のCu²⁺が左辺に、E゜小のZnが左辺に存在していることがわかります。以上のことにより、矢印を揃えて、半反応式を書くと、
Zn→Zn²⁺+2e⁻
Cu²⁺+2e⁻→Cu
となり、高校化学で学んだ通りの結果を得ることができます。
ここで、標準酸化還元電位の解法を完全にステップ化してしまいましょう。
step1:存在する物質を含む半反応式を電子を左辺に配置して書き出す。
step2:E゜の大小を比較して、進行方向を決める。E゜大なら左→右に進行する
step3:E゜大の物質が左辺に、E゜小の物質が右辺にあることを確かめる
存在しない場合:反応は何も起こらない
存在する場合:step2の進行方向に従う
以上の3stepを踏めば、すべての標準酸化還元電位の問題を解くことができます。ということでこの解法ステップを用いて、問題演習をしていきましょう。
標準酸化還元電位の問題演習
Ag⁺を含む水溶液に、亜鉛版を入れるとどのようなことが起こるか?
我々は先ほど学んだ解法ステップを着実に遂行すれば良いのです。
まずは存在する物質(Ag⁺とZn)を含む半反応式をお手持ちの表から探して、書き出しましょう。
※自分で表から探すのが大事です。
step1:存在する物質を含む半反応式を電子を左辺に配置して書き出す。
step2:E゜の大小を比較して、進行方向を決める。E゜大なら左→右に進行する
step3:E゜大の物質が左辺に、E゜小の物質が右辺にあることを確かめる(条件)
存在しない場合:反応は何も起こらない
存在する場合:step2で決めた進行方向に従う
step1:存在する物質を含む半反応式を電子を左辺に配置して書き出す。
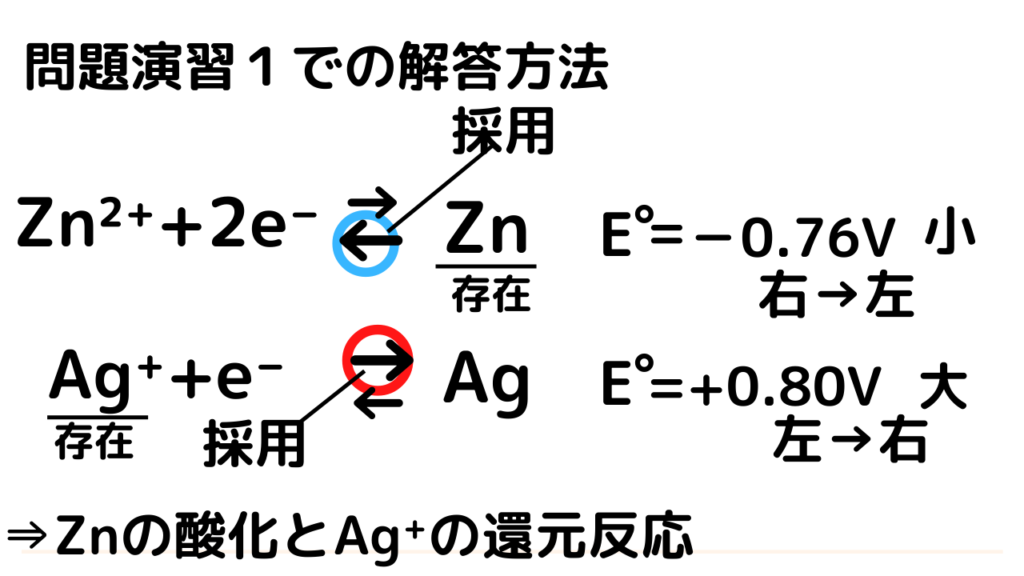
表から以下の2つの半反応式を書きだすことができました
Zn²⁺+2e⁻⇄Zn (標準酸化還元電位)E゜=ー0.76V
Ag⁺+e-⇄Ag (標準酸化還元電位)E゜=+0.80V
step2:E゜の大小を比較して、進行方向を決める。E゜大なら左→右に進行する
今、+0.80V > ー0.76Vなので、Agの半反応式が左→右、Znの半反応式が左→右に進行します。
step3:E゜大の物質が左辺に、E゜小の物質が右辺にあることを確かめる
Zn²⁺+2e⁻⇄Zn (標準酸化還元電位)E゜=ー0.76V
Ag⁺+e-⇄Ag (標準酸化還元電位)E゜=+0.80V
E゜大の物質Ag⁺は左辺に、E゜小の物質Znは右辺に確かに存在します。
よって、step2で決めた進行方向に従います。
つまり、Znの酸化、Ag⁺の還元反応が起こることが予測できます。
画像で表現する=実際に解くノートは次のようになります↓↓
先ほどのテキスト(文章)のみでのステップを丁寧に確認した人は画像への理解が一段と早いと思いますので、必ずテキストのステップを確認してください。
Fe(2+)を含む水溶液にSnを入れるとどのようなことが起こるか。
解法は全く同じですので、画像での確認後、理解できなかった人はテキストで確認しましょう。

まずは存在する物質(Fe²⁺とSn)を含む半反応式をお手持ちの表から探して、書き出しましょう。
※自分で表から探すのが大事です。
step1:存在する物質を含む半反応式を電子を左辺に配置して書き出す。
step2:E゜の大小を比較して、進行方向を決める。E゜大なら左→右に進行する
step3:E゜大の物質が左辺に、E゜小の物質が右辺にあることを確かめる(条件)
存在しない場合:反応は何も起こらない
存在する場合:step2で決めた進行方向に従う
step1:存在する物質を含む半反応式を電子を左辺に配置して書き出す。
表から以下の3つの半反応式を書きだすことができました
Sn²⁺+2e⁻⇄Sn (標準酸化還元電位)E゜=ー0.14V…①
Fe³⁺+e-⇄Fe²⁺ (標準酸化還元電位)E゜=+0.77V…②
Fe²⁺+2e⁻⇄Fe (標準酸化還元電位)E゜=ー0.44V…➂
step2:E゜の大小を比較して、進行方向を決める。E゜大なら左→右に進行する
②+0.77V > ①ー0.14Vなので、②は左→右、①は右→左へ進行します。
② > ➂なので、同様に、②は左→右、③は右→左へ進行します。
① > ➂なので、①は左→右、③は右→左に進行します。
step3:E゜大の物質が左辺に、E゜小の物質が右辺にあることを確かめる
3つあるのでそれぞれを大・中・小としましょう。
Sn²⁺+2e⁻⇄Sn (標準酸化還元電位)E゜=ー0.14V…①
Fe³⁺+e-⇄Fe²⁺ (標準酸化還元電位)E゜=+0.77V…②
Fe²⁺+2e⁻⇄Fe (標準酸化還元電位)E゜=ー0.44V…➂
E゜大の物質Fe²⁺は右辺に、E゜中の物質Snは右辺に、E゜小の物質はFe²⁺は左辺に存在します。
つまり、E゜大の物質が左辺に、E゜小の物質が右辺にあるという条件を満たせていません
したがって、何も反応は起こりません。
以上です。問題演習を重ねていけば、ワンパターンですので確実に解けると思います。
誤りがあればコメントで指摘していただけると幸いです。修正します。




コメント