今回の記事では、高校の高分子分野で学ぶ、「ビニロン」について作り方と計算方法を解説します。
ビニロンとは、「日本で初めて開発された合成繊維」のことです。魚網などに使われます。
この記事を読んで、下の問題を一瞬で解くことができます↓↓
ポリビニルアルコールのヒドロキシ基の30%をアセタール化したビニロンを100g作りたいとき、以下を求めよ。
(1)必要なビニルアルコールの質量
(2)必要な39%のホルムアルデヒドの式量
超難しそうですよね。でも、大丈夫!!この記事を見れば解けるようになります。
では、さっそくやっていきましょう
ビニロンをつくるまでのステップ
まずは、結論。ビニロンは以下の3ステップによって作られます↓↓
①アセチレンに酢酸を付加して、ポリ酢酸ビニルをつくる(付加重合)
②ポリ酢酸ビニルをけん化して、ポリビニルアルコールをつくる
③ポリビニルアルコールのOH基をホルムアルデヒドで一部アセタール化⇒ビニロン完成
視覚的にわかりやすくするために1つずつ画像で解説していきます。
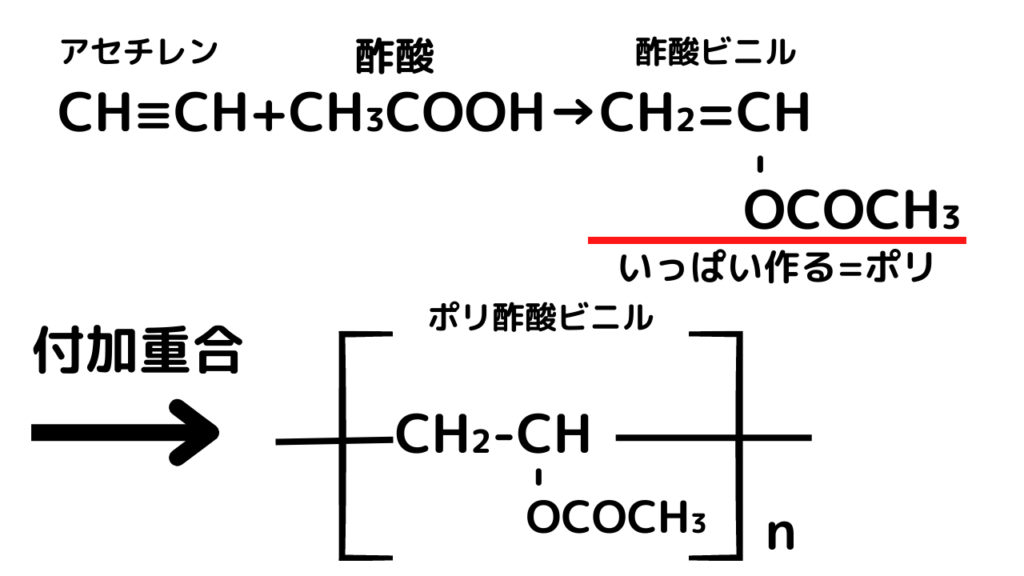
ここは単純な化学反応ですね。ビニロンは「高」分子ですから、たくさんほしいので、重合します。
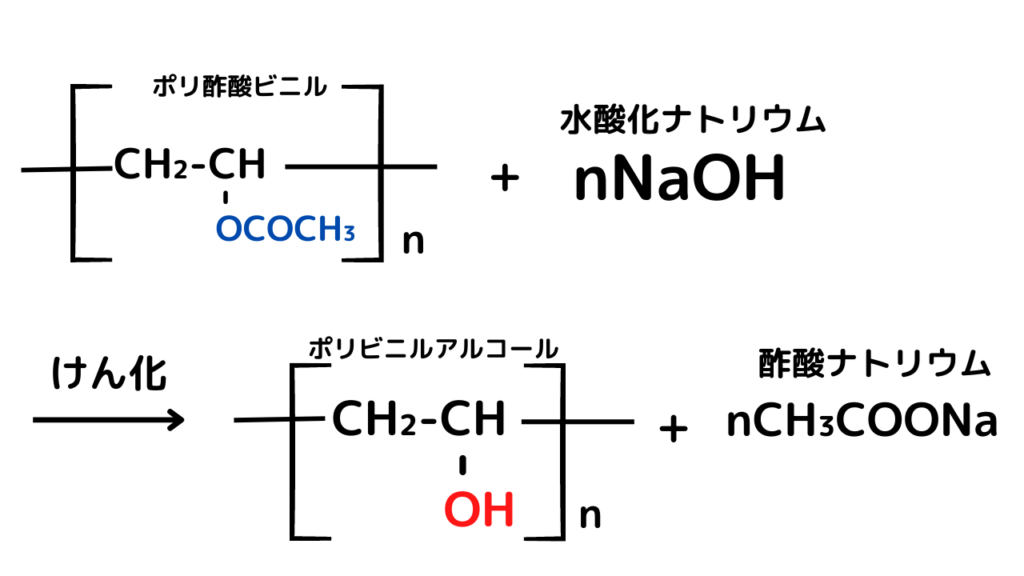
作られたポリビニルアルコールはOH基を持つため、水溶性を示します。
ビニロンは合成繊維で魚網に使われると最初に紹介しました。
繊維が水溶性では魚網には使えませんよね。(海に入れた瞬間に無くなってしまう)
ということでここから水溶性の性質をなくします。
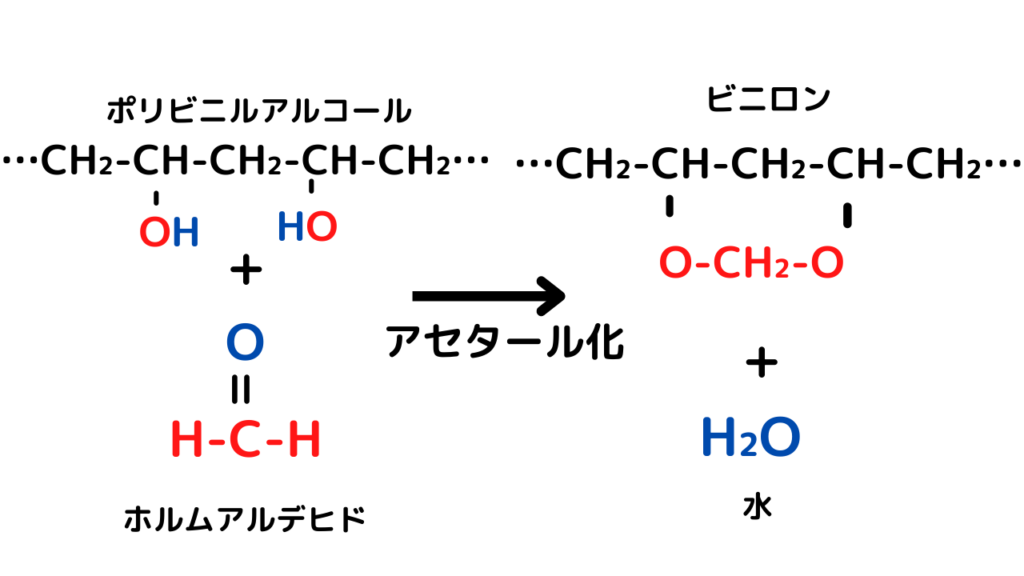
アセタール化によって水溶性の物質から、水に溶けにくいのビニロンができました。
これがアセタール化する理由となります。
水溶性のポリビニルアルコールから、水に溶けにくいビニロンを作るため。
以上が、ビニロンの作り方ステップになります。ここからは計算方法となります
【裏技!?】ビニロンの計算方法:式2つだけ
まずは結論。ビニロン周りの計算で覚える式は以下の2つです↓↓

88は、ポリビニルアルコール2つ分の分子量を指します。
ビニロンを作るためには、ビニルアルコールを2つ使う必要があります。(上の作り方を参照)
ポリビニルアルコールの「一部」をアセタール化して、ビニロンを作ります。
すなわち、ビニロンには、「アセタール化された部分」と「されていない部分」の2つが存在します。
されていない部分はビニルアルコール2つ分ですから、分子量は88です。
アセタール化された部分は、水素が2つ抜けて、CH₂が追加されるので
分子量は12だけ多い、100となります。

これは、複雑ぽいですが、簡単な比の計算ですね。
ポリビニルアルコール2つとホルムアルデヒド1つでアセタール化するので、比は同じはずです。
これらの式①、式②でビニロン周りの計算は簡単にできます。
最初の問題を瞬殺してみよう
先ほどの式を使って、最初の問題に挑戦してみましょう。
ポリビニルアルコールのヒドロキシ基の30%をアセタール化したビニロンを100g作りたいとき、以下を求めよ。
(1)必要なビニルアルコールの質量
(2)必要な39%のホルムアルデヒドの式量
<解説>
(1)は式①に、(2)は式②に値をそのまま代入すればよさそうですね。
未知数は、AとBと置きます↓↓

(1)からAの値を出せば、(2)のBの値を出すことができますね。計算はお願いします。
以上です。誤りがあれば修正します。




コメント