今回の記事では、有機化学の基礎中の基礎物質「メタン・エチレン・アセチレンの製法」について解説していきます。それぞれがアルカン、アルケン、アルキンの代表的な物質なので、ここで確実に押さえましょう。
この記事を読んで以下のことを理解できればOKです↓↓
・メタン、エチレン、アセチレンの実験室での反応を書ける
・メタン、エチレン、アセチレンは全て水上置換法で集める
では、さっそくやっていきましょう。
まずは結論。メタンCH₄の実験室での製法はこちら↓
●実験室:酢酸ナトリウムCH₃COONaの無水物と水酸化ナトリウムNaOH(またはソーダ石灰)を加熱して得られる。
反応はこちら↓
CH₃COONa + NaOH → CH₄ + Na₂CO₃
発生したメタンCH₄は水上置換法で集めます=水に溶けにくい
●工業的製法:天然ガスから得る
工業的製法は知っていたほうがいいですが、実験室で行えるなら、授業でみなさんも見せれるから教育的に良いですよね。つまり、テストにも出しやすい。よって、実験室の反応を覚えておくのが最優先です。
まずは結論。エチレンの実験室での製法はこちら↓
●実験室:濃硫酸H₂SO₄を160℃~170℃に加熱し、エタノールを加える(脱水反応)
反応はこちら↓
C₂H₅OH → C₂H₄ + H₂O
発生したエチレンC₂H₄は水上置換法で集めます=水に溶けにくい
濃硫酸H₂SO₄は、触媒として利用=脱水反応を促進させるため
実験室でのエチレンC₂H₄の製法における注意点を1つあげよ。
<解答>空びんを置き、逆流するのを防ぐようにする点。
エタノールの脱水反応。
今回のエチレンの製法はエタノールの分子内脱水反応と言います。ここでエタノールの脱水反応についてまとめておきます。
●分子内脱水反応:エタノールC₂H₅OHを1つ使って、脱水。160~170℃という条件のもと、濃硫酸H₂SO₄を触媒として、エチレンC₂H₄を作る
●分子間脱水反応:エタノールC₂H₅OHを2つ使って、脱水。130℃程度という条件のもと、濃硫酸H₂SO₄を触媒として、ジエチルエーテルC₂H₅-O-C₂H₅を作る

要するに、分子内なら1つ、分子間なら2つで
温度条件が異なる!ってことだけ押さえればOK!
●工業的製法:ナフサの熱分解によって得られる
工業的製法は知っていたほうがいいですが、実験室で行えるなら、授業でみなさんも見せれるから教育的に良いですよね。つまり、テストにも出しやすい。よって、実験室の反応を覚えておくのが最優先です。
まずは結論。アセチレンC₂H₂の実験室での製法はこちら↓
●実験室:炭化カルシウムCaC₂(カーバイド)に、水を加える
反応式はこちら↓
CaC₂ + 2H₂O →C₂H₂ + Ca(OH)₂
発生したアセチレンC₂H₂は水上置換法で集めます=水に溶けにくい
実験室の製法では、アセチレンは作り方も聞かれるので画像で説明します↓↓
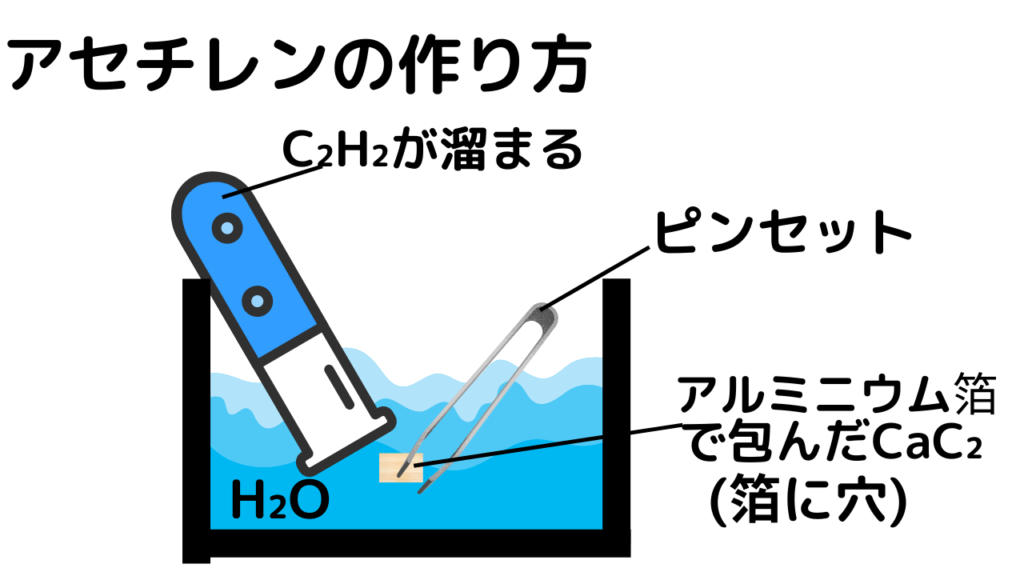
上の画像のように、アルミニウム箔に包んだカーバイドCaC₂を、ピンセットで持って、水に突っ込むことで作ることができます。「箔に穴」とありますが、アルミニウム箔に穴がないとアルミニウムと水の反応になってしまい、カーバイドが水と反応できないという当たり前のことです。
●工業的製法:2種類あります。
①メタンの熱分解から得られる(反応式があるので覚えましょう)
2CH₄ → C₂H₂ + 3H₂
②ナフサの熱分解から得られる
工業的製法は知っていたほうがいいですが、実験室で行えるなら、授業でみなさんに見せれるから教育的に良いですよね。つまり、テストにも出しやすい。よって実験室の反応を覚えておくのが最優先です。
アセチレンの特徴2つ
アセチレンには特有の性質が2つあります↓
①アセチレンは、燃焼熱が大きいため、酸素と反応させると高温の酸素アセチレン炎が生じる。この性質から金属の溶接に使われる。
②アセチレンとアンモニア性硝酸銀を反応させると、銀アセチリドAgC≡AgCの白色沈殿を作る⇒アセチレンの検出法
以上です。あなたの有機化学の理解が深まることを願って…
誤りがあれば、コメント指摘していただけると幸いです。修正します。




コメント