今回の記事では、大学化学における重要な理論である「分子軌道理論」について解説していきます。3つのルールを覚えることで分子軌道理論を完璧にすることができます。
この記事を読んで、以下のことを理解できればOKです↓↓
①分子軌道ができる際の3つのルールを覚える
②水素、ヘリウムについて分子軌道を考えられる
今は、分子軌道の3ルールも作り方もなんやねん状態なので、わからなくて大丈夫です。これから丁寧に説明していきます。それでは頑張っていきましょう!
本編に入る前に…
今回の分子軌道は、原子軌道と電子配置の理解が絶対に必要です。そのため、「電子軌道(1s,2pなど)」、「構成原理」と「フントの規則」、「パウリの原理」が曖昧な人は、先に以下の記事を読むことを強くおすすめします↓↓
電子(原子)軌道わからすぎて大学初日から泣きそうな奴。ちょっと来い!
では、電子配置のルールを理解したところで「分子軌道」についてやっていきましょう。
【重要】分子軌道ができるときの3ルール
まずは結論。超重要な分子軌道の3ルールはこれです↓↓
①分子軌道の数は、原子軌道と同じ数であること
②もとの原子軌道よりも、安定な分子軌道と不安定な分子軌道ができる
③電子は電子配置のルールに従って、改めて配置しなおされる
この3つのルールを駆使することで、ほとんどの分子軌道理論を解くことができます。
後で、実際にこのルールを使いますので、今はとりあえずメモっておいてください。
先にルールを提示しましたので、類似しますが、分子軌道のおおまかな定義についても触れておきます
原子が分子をつくるとき、原子の原子軌道を材料にして、全く新しい「分子軌道」をつくる。このとき電子は分子軌道に改めて入りなおす。
それでは、さっそく水素の分子軌道について考えていきます。
水素の分子軌道考えよう
まずは結論。水素の分子軌道は以下になります↓↓
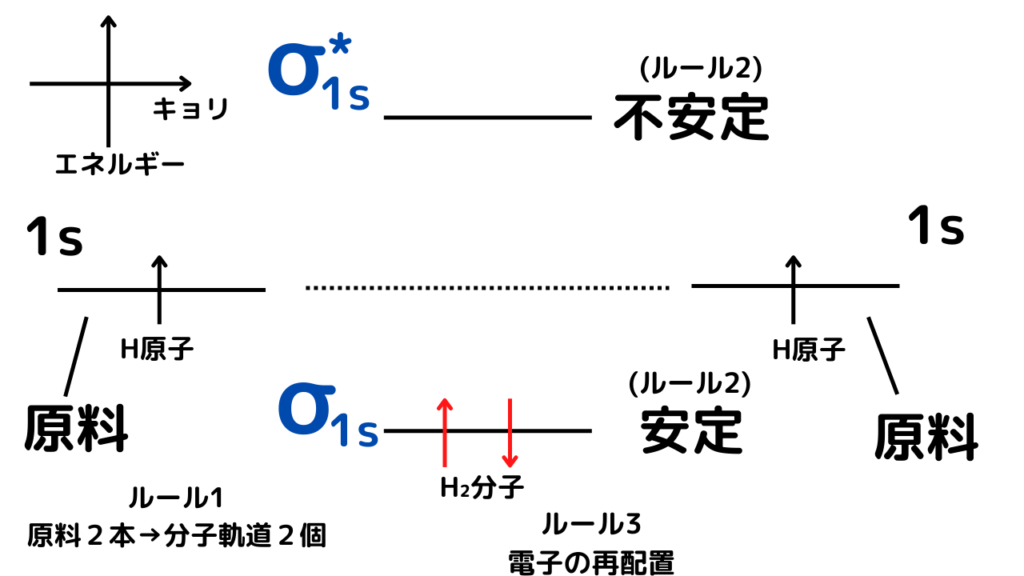
今からの説明を常に上の画像に戻りながら確認してください。
(1)分子軌道を平面上に書く際は、キョリーエネルギー平面を用意します。
(2)H原子の原子軌道(原料)から、H₂分子の分子軌道を作るので、左右にH原子の原子軌道を置きます。
①分子軌道の数は、原子軌道と同じ数であること
②もとの原子軌道よりも、安定な分子軌道と不安定な分子軌道ができる
③電子は電子配置のルールに従って、改めて配置しなおされる
ここからは、先ほどの3ルールに従って、分子軌道を作ります。
(3)ルール①は「分子軌道の数は、原子軌道と同じ数であること」です。
H原子の原子軌道は2つ ⇒ H₂分子の分子軌道は2つできます。
用意した原料分しか作ることができないという当たり前のイメージで大丈夫です。
(4)ルール②は「もとの原子軌道よりも、安定な分子軌道と不安定な分子軌道ができる」です。
安定と不安定を判断するものは、「エネルギー」です。
エネルギーが高い=不安定状態、エネルギーが低い=安定状態となります。
歩くこと(エネルギー低い)は、安定にできますが、ダッシュ(エネルギー高い)を保つのは難しいというイメージをもってもらえれば、エネルギー高低の判断がわかりやすいと思います。
そのため、原子軌道よりもエネルギーが高い場所と低い場所にそれぞれ分子軌道を書きます。
※結合するには、H原子同士が近づく必要性があるため、原子軌道よりも内側に分子軌道を書きます。
(5)ルール③は「電子は電子配置のルールに従って、改めて配置しなおされる」です。
電子配置のルールとは、構成原理、パウリの原理、フントの規則のことです。
まず、構成原理より、電子はエネルギーの低い軌道に順番に入っていくため、H原子の原子軌道よりも低い分子軌道のほうに2つ入ります。そして、パウリの原理より、スピンの異なる向きで電子を表します。
これで、H₂分子の分子軌道が完成しました!!!
σ結合とは
先ほどの水素の画像で気になっている人もいると思います。まずは結論。σ結合とは↓↓
結合軸方向を向いた原子軌道同士による結合である。(Wikipedia参照)
結論づけてから、言うのもあれですが、正直こんなのは覚えなくて大丈夫です。
あなたが知りたいのは、「σ結合ってなんでσ結合って言うのか」ではないですか?
この分野では、σ結合だったり、π結合だったり、急にでてきましたから。

先ほどの水素原子から水素分子を結合するとき、s軌道同士が、上記のように結合します。
そこには重なり部分が生じ、重なり部分を見ると円形に見えることがわかります。
ここでs軌道は球の形をしていたことを思い出してください。
円形を別の言い方をすると、s軌道(球)の断面と同じ形であると言えます。
そこで、アルファベット「s」のギリシャ文字である「σ」を使うことにしました。
●σ結合は、s軌道のギリシャ文字変換に過ぎない。
●重なり部分がs軌道の断面なら、σ結合。
※エネルギーが高い=不安定な状態の分子軌道の結合には、「*」をつけて、「シグマスター結合」と呼びます。
ヘリウムの分子軌道を考えよう
先ほどの水素分子と同様に、ヘリウム分子の分子軌道についても考えてみましょう。
あなたは、ヘリウムが水素分子のようにH₂にはならないことが分かっている。
結論に入る前に、あなたの事前の知識からヘリウムには、He₂が存在しないことがわかっています。
この理由を高校では、「希ガスで安定だから」と学習したと思いますが、この分子軌道の考えを用いるとさらに、理解が深まります。
ということで、結論。ヘリウムの分子軌道は以下のようになります。
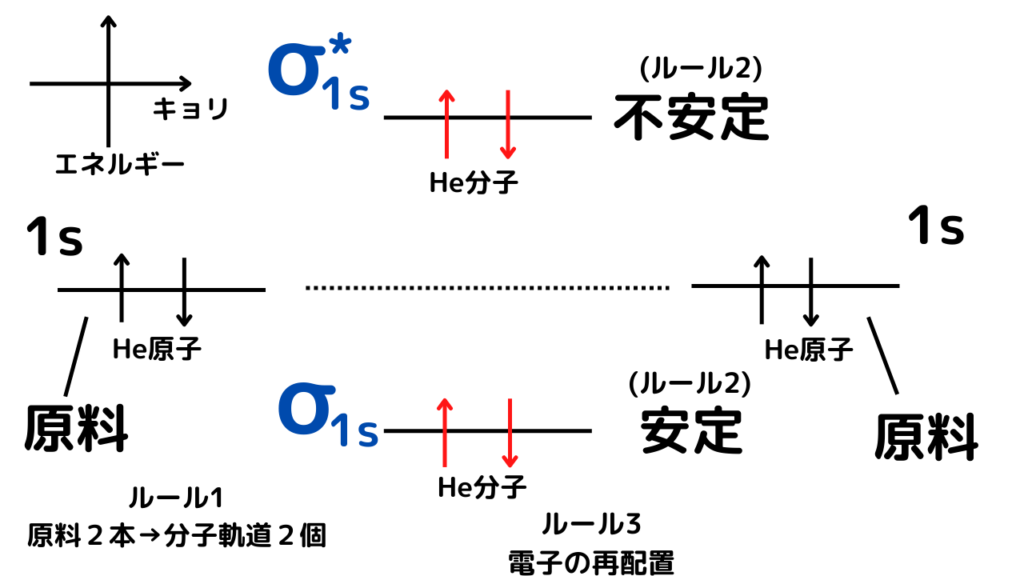
分子軌道自体の作り方は、先ほどの水素の分子軌道の作り方と全く同じなので省略します。
水素とヘリウムの違いは、ヘリウムが合計で2個多いため、
エネルギーが不安定な分子軌道側にも、電子を入れざるをえないということです。
つまり、ヘリウムは、元々よりも安定な奴もできるが、同じくらい不安定な奴ができてしまうのです。
安定&安定(原子軌道のまま) VS 超安定&超不安定(分子軌道になる)
という戦いになるわけです。
化学の世界では、物質はなるべく安定になりたいですから、超不安定な状態のものを持っていたくないのです。
よって、勝者は、原子軌道のままの安定&安定コンビになります。
以上のことから、ヘリウムは分子をつくらないことが説明できます。
まとめ
最後にルールの再確認だけしときましょう。
①分子軌道の数は、原子軌道と同じ数であること
②もとの原子軌道よりも、安定な分子軌道と不安定な分子軌道ができる
③電子は電子配置のルールに従って、改めて配置しなおされる
この3つのルールをキョリーエネルギー平面に表すことで、分子軌道を作ることができます。
p軌道を含む酸素分子の分子軌道についてはまた今度に解説します。
以上です。誤りがあればコメント指摘していただけると幸いです。修正します。




コメント