今回の記事では、大学の無機化学に登場する「vsepr理論(vsepr則)」について練習問題を中心に解説していきます。どの化合物であっても、解き方はワンパターンですので、確実に解けるようにしていきましょう。
この記事を読んで以下のことが理解できればOKです↓↓
vsepr理論によって分子構造を予測することができる
では、さっそくやっていきましょう。
※vsepr理論がわからなくて来たあなたはいきなり練習問題から入らないでください。まずはステップを理解しないと解くことが難しいです。
vsepr理論による分子構造予測
まずは結論。vsepr理論による分子構造予測は以下の5つステップで構成されています。
①中心元素と周辺元素を決める
②結合に関与する全電子数を数える
・中心元素は、価電子を全て
・周辺元素は元素によって異なる
{ハロゲン:1個、OH:1個、O(ー):1個、=O:2個}
③中心元素まわりの電子対の数を求める
・②で求めた全電子数の半分の値
・=Oを持つ場合のみ、(全電子数の半分ー1×=O)の値
④③によって分子構造の基本形が決まる
⑤元素と電子を構造に配置する
これら上記の5つのステップを確実に遂行することで、vsepr理論による分子構造予測できるようになります。練習問題で詳しくやるので、今はメモっておいてください。
①~③で電子対の数がわかることで、電子対の数に応じて、④分子構造の基本形が決まります。
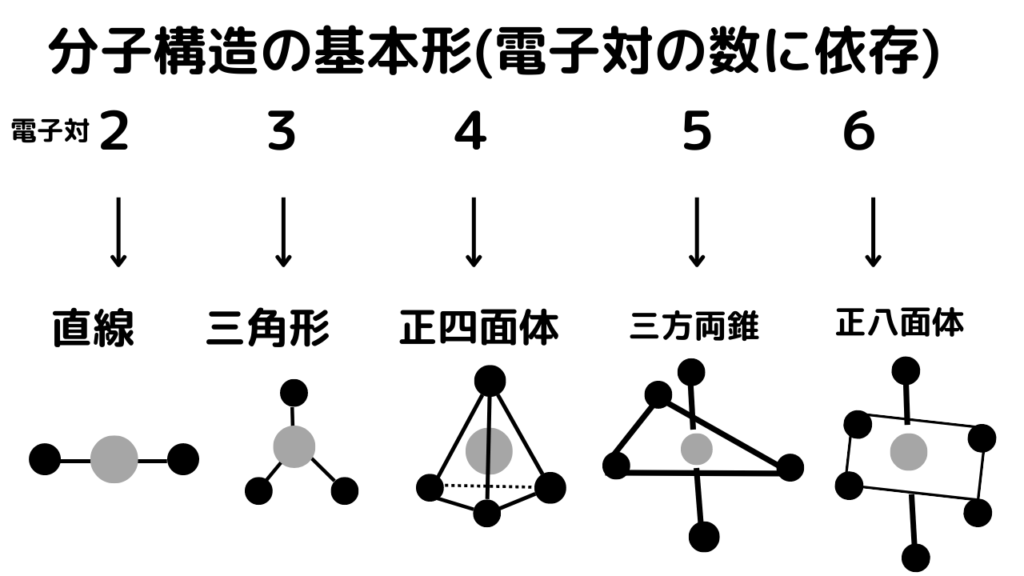
電子対の数に応じて、画像のように電子対が2個であれば直線、3個で三角形、4個で正四面体、5個で三方両錐、6個で正八面体となります。三方両錐と正八面体は図形の簡略化のため、上のように書くことが多いです。
※灰色のマルが中心元素、黒色のマルが周辺元素を指しています。
基本形が三方両錐(電子対の数=5)のとき、周辺元素の入るスペース(黒丸)は5個あります。
ここで、周辺元素の数が3個しかない場合、2か所のスペースに空きができます。
このスペースには「非共有電子対」が入ることを忘れないでください。
電子対が5個の場合の分子構造である「三方両錐」には、次のような注意が必要です。
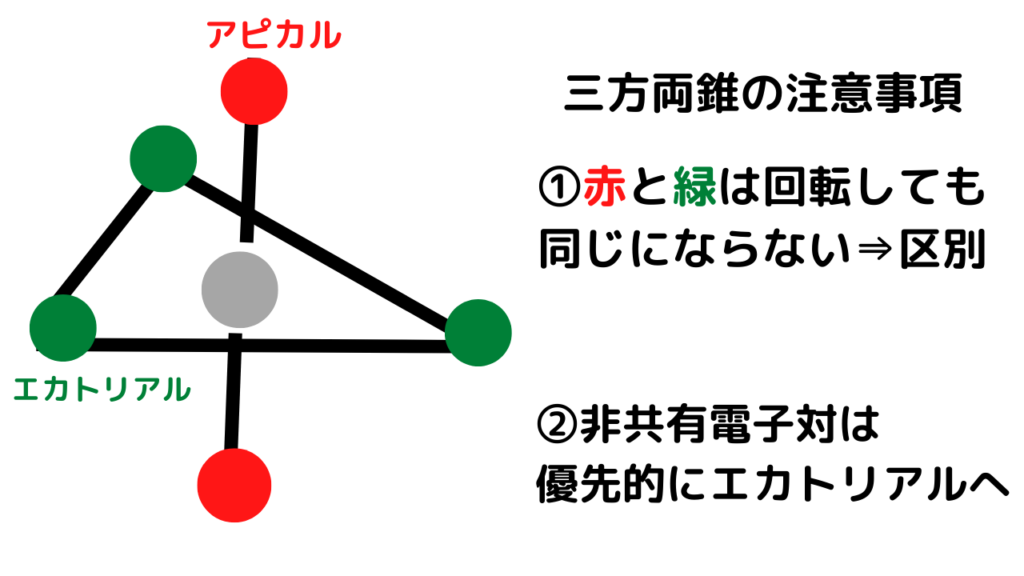
画像上の赤丸は「アピカル」、緑丸は「エカトリアル」という固有の名前がついています。
そして、非共有電子対は、優先的に「エカトリアル」の位置に入ります。
では、これらの点を踏まえ、練習問題を解いてみましょう。
【練習問題】ClF₃の分子構造予測
vsepr理論を用いて、ClF₃の分子構造を予測せよ
5つのステップ通りに着実にやっていきましょう
①中心元素と周辺元素を決める
②結合に関与する全電子数を数える
・中心元素は、価電子を全て
・周辺元素は元素によって異なる⇒ハロゲン:1個、OH:1個、O(ー):1個、=O:2個
③中心元素まわりの電子対の数を求める
・②で求めた全電子数の半分の値
・=Oを持つ場合のみ、(全電子数の半分ー1×=O)の値
④③によって分子構造の基本形が決まる
⑤元素と電子を構造に配置する
ここでは、中心元素が塩素Cl、周辺元素がフッ素F×3個となります
・中心元素は全ての価電子を数えます。
よって中心元素の塩素Clの価電子は7個です。
・周辺元素のハロゲンは1個として数えます
よって周辺元素のフッ素Fは1個×3で3個です
よって、結合に関与する全電子数は10個となります。
電子対の数は、②で求めた全電子数の半分の値なので、
10個の半分である「5つ」となります。
ステップ③から、電子対の数が「5つ」となったので、
分子構造は「三方両錐」に決まりました。
三方両錐の注意事項を踏まえて、元素と電子を配置します。
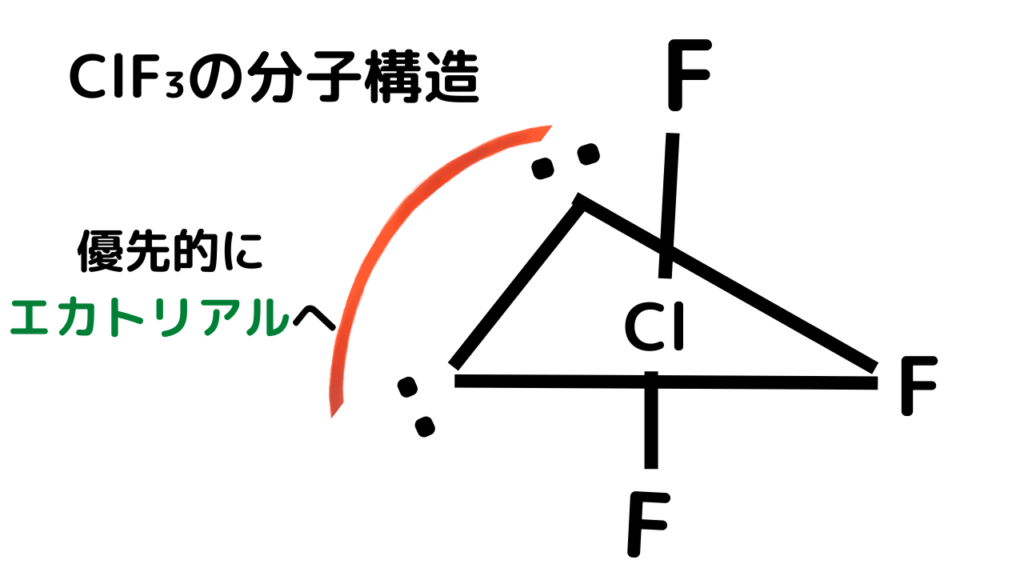
三方両錐より、周辺元素は5か所に入ることができますが、フッ素F自体は3つしかありません。
そのため、2か所の空きができます。そこには非共有電子対が入ります。また、非共有電子対はエカトリアルへ優先的に入ります。
以上でClF₃の分子構造が決定しました。
【練習問題】I₃(-)の分子構造予測
vsepr理論を用いて、I₃(-)の分子構造を予測せよ
陰イオン化されてますが、同様に5つのステップ通りに着実にやっていきましょう
①中心元素と周辺元素を決める
②結合に関与する全電子数を数える
・中心元素は、価電子を全て
・周辺元素は元素によって異なる⇒ハロゲン:1個、OH:1個、O(ー):1個、=O:2個
③中心元素まわりの電子対の数を求める
・②で求めた全電子数の半分の値
・=Oを持つ場合のみ、(全電子数の半分ー1×=O)の値
④③によって分子構造の基本形が決まる
⑤元素と電子を構造に配置する
ここでは、中心元素がヨウ素I、周辺元素がヨウ素I×2個となります
・中心元素は全ての価電子を数えます。
よって中心元素のヨウ素Iの価電子は7個です。
・周辺元素のハロゲンは1個として数えます
よって周辺元素のヨウ素Iは1個×2で2個です
・陰イオン化されているため、負電荷を1個を持っています
よって、結合に関与する全電子数は10個となります。
電子対の数は、②で求めた全電子数の半分の値なので、
10個の半分である「5つ」となります。
ステップ③から、電子対の数が「5つ」となったので、
分子構造は「三方両錐」に決まりました。
三方両錐の注意事項を踏まえて、元素と電子を配置します。
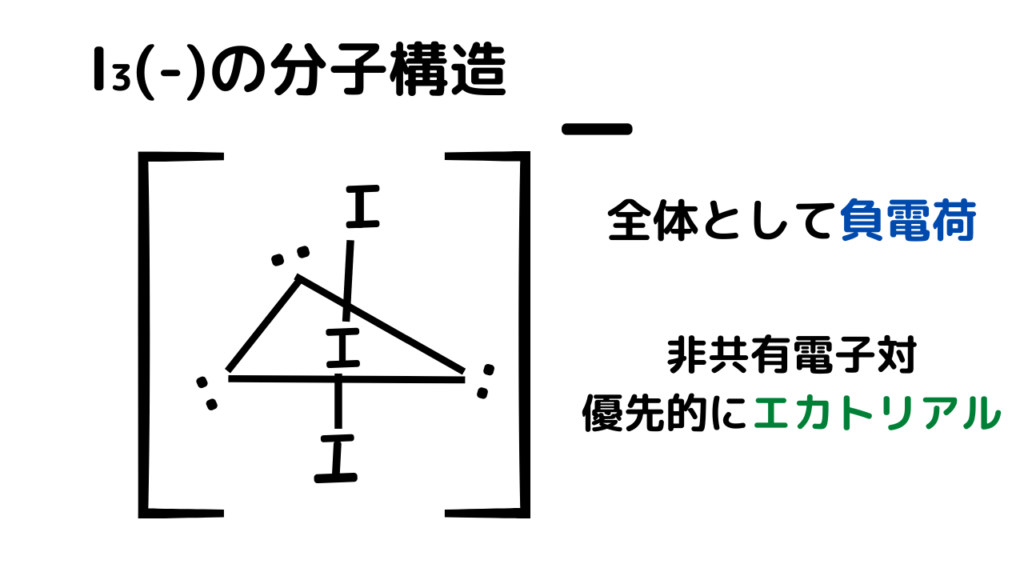
負電荷をもつため、分子構造全体として負電荷をもつことに注意しましょう。
以上でI₃(-)の分子構造が決定しました。
【練習問題】ClO₃(-)の分子構造予測
vsepr理論を用いて、ClO₃(-)の分子構造を予測せよ
今回は「=O」を含んでいます。
①中心元素と周辺元素を決める
②結合に関与する全電子数を数える
・中心元素は、価電子を全て
・周辺元素は元素によって異なる⇒ハロゲン:1個、OH:1個、O(ー):1個、=O:2個
③中心元素まわりの電子対の数を求める
・②で求めた全電子数の半分の値
・=Oを持つ場合のみ、(全電子数の半分ー1×=O)の値
④③によって分子構造の基本形が決まる
⑤元素と電子を構造に配置する
ここでは、中心元素が塩素Cl、周辺元素が酸素O×3個となります
・中心元素は全ての価電子を数えます。
よって中心元素の塩素Clの価電子は7個です。
・周辺元素のO(ー)は1個として数えます
よって周辺元素のO(ー)は1個です。
・周辺元素の=Oは2個として数えます。
よって周辺元素の=Oは2個×2個で4個です。
よって、結合に関与する全電子数は12個となります。
電子対の数は、=Oを持つ場合のみ、(全電子数の半分ー1×=O)の値ですので、
(12÷2ー1×2)=4で、電子対の数は「4つ」となります。
ステップ③から、電子対の数が「4つ」となったので、
分子構造は「正四面体」に決まりました。
正四面体に、元素と電子を配置します。
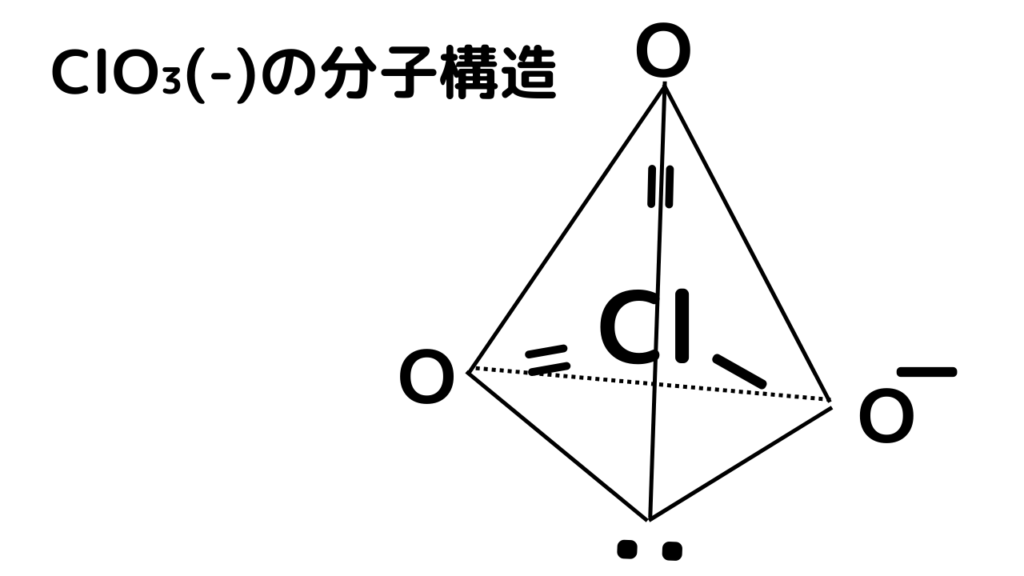
以上でClO₃(-)の分子構造が決定しました。
以上です。誤りがあればコメント指摘していただけると幸いです。修正します。




コメント
このステップを踏んで硝酸イオン NO3- の構造を実際に書きました。
中心Nの価電子 5
O- 1×2つ
O–(二重結合)2×1つ
陰イオン化 1つ
計10個
O(二重結合)が含まれてるため
(10/2 – 1×1つ)=4⇨正四面体
しかし、実際の硝酸イオンは3の平面三角形らしいです。何が違うのでしょうか。
ねくおです。
お勉強お疲れさまです。コメントありがとうございます。
前提条件がたくさん必要なため回答が少し長くなります。
以下、回答とさせていただきます。
NO₃(-)は、ルイスの構造(一般的な構造式)で表すことができません。
理由としてN-O結合が単結合と二重結合の中間の結合をしているため
どちらを書いてよいかわからないためです。(ベンゼンと同じです。)
しかし、共鳴構造であればNO₃(-)を図示することができます。
硝酸塩
上記のリンクは硝酸塩のWikipediaです。性質という見出しに共鳴構造が図示されています。
O(-)が2つあるじゃないかと思われますが、Nが陽イオン化されているため分子全体としてはマイナスは1つだけとなります。
ここで共鳴構造の1つについてvsper則を適用してみましょう。
中心のNの価電子:5つ
O(-):2個×1=2つ
=O(二重結合):1個×2=2つ
陽イオン化:-1(電子にとってはマイナスです)
陰イオン化:O(-)に組み込まれていますので考えなくて大丈夫です。
計8個の電子があります。
=O(二重結合)が含まれているため
(8/2-1)=3→平面三角形
よって平面三角形となります。
窒素の手の数は基本的に3本です(NH₃のように)
樽と経過さんの場合,Nが陽イオン化していないため手の数が4本になってしまっています。
陽イオン化して手の数を減らすことができれば合っていると思います。
最後にですが、vsepr則は主にハロゲン化合物または第3周期以降の構造予測に使われます。
そのため、vsepr則が硝酸イオンの構造予測の方法の最適解ではない場合があります。
ご自身で硝酸イオンの構造について無機分野の先生などに確認をとっていただければと思います。
誤りがあれば再度コメントいただけると幸いです。修正します。