今回の記事では、主に無機化学の序盤に登場する「電子殻と原子軌道」について解説します。大学入学後、理系が最初にぶつかる壁である「軌道」について簡単に説明していきます。
この記事を読んで、以下のことを理解できればOKです↓↓
①高校:電子殻⇒大学:原子軌道(電子軌道)
②軌道の形(S軌道とP軌道)
今は、なんのこっちゃわからんと思います笑。これから丁寧に説明していきます。それでは頑張っていきましょう!
※原子軌道の理解には、電子殻についての理解が必須です。そのため、最初から飛ばさずに読み進めることをすすめます。理解しないまま、「まとめ」だけ見ても、おそらくなんのこっちゃわからないと思うので、素直に1から見ていきましょう。
電子殻の復習
まずは、高校でやった電子殻について復習しましょう。
結論:電子を収納できる箱!!!
①K殻、L殻、M殻、N殻、O殻…という大きさが違う箱がある
②基本的には、小さい殻から順に電子を入れていく
わかりやすく表すとこのような感じでしょうか↓↓

箱の大きさが違う=収納できる電子の個数も違います。上の画像のように、K殻に2個、L殻に8個、M殻に18個、N殻に32個の電子が収納されます。
K殻から順に入れていき、K殻が満タンになったら、L殻に電子を収納します。L殻が満タンになったら、M殻に収納していく…というように、小さい殻から電子を収納していきます。M殻からは遷移元素などが絡むため、「基本的に」という言葉がありますが、ここでは考えなくて良いです。(難しいのは無視無視!!)
このルールに関しては、引っ越しのダンボール箱をイメージしてください。小さい箱と大きい箱があり、小さい箱に入るのであれば、わざわざ大きい箱を使う必要はありませんよね。そんな感じで、まずは小さい箱に電子を詰めていきます。(私はこんな感じで覚えました笑)
電子殻の復習は以上です。
電子殻と原子軌道について
ここから、大学の分野に一歩踏み込みます。まずは、結論からどうぞ↓
①電子殻(箱)に番号つける(主量子数)
②箱の中を詳細に見る(収納グッズがたくさんある)⇒原子軌道(s,p,d,f,g…)
③原子軌道は、主量子数に対応している
④箱の大きさが違うので、入れる収納グッズの数も違う
⑤軌道の1個につき電子は2個収納することできる
はい笑。なんのこっちゃですよね。全然大丈夫です。今から説明していきます。
①は簡単です。小さい電子殻(箱)から順に1,2,3…と番号を付けていきます。ということは、
1=K殻、2=L殻、3=M殻、4=N殻、5=O殻…となります。①はこれで終了。この番号を主量子数と言います。
あなたがモノを箱に入れるとき、箱の中に収納しやすいように、更に箱や区切りをつけませんか?
以下の画像のような感じです↓↓

電子殻は、かなり大雑把な考え方なんです。電子殻はそれぞれの箱に何個入るかしかわかりません。K殻という箱には2個、L殻という箱には8個といった具合です。そこで、登場するのが原子軌道です。
原子軌道では、箱の中に、収納グッズ(軌道)をいくつか設けることで、もう少し詳しく電子の居場所を理解できます。K殻という箱の、s軌道には電子が2個あるといった具合です。(個数に関しても今は無視して良い)
電子殻:どでかい箱(大雑把)。箱に入れる電子の個数しかわからない。
原子軌道:収納グッズ(丁寧)。箱に入った電子がどこにいるかわかる。
②の段階では、大雑把な電子殻⇒丁寧な原子軌道があるんだなぁと思ってください。
※知らない名称が出てきた(s軌道?、p軌道?)となってしまった方へ↓
電子殻にも順番と名称(K殻⇒L殻⇒M殻⇒N殻…)があるように、原子軌道も順番があります。原子軌道はs軌道から始まって、p軌道⇒d軌道⇒f軌道となります。電子殻(どでかい箱)が大文字なのに対し、原子軌道(収納グッズ)は小文字で表記します。
電子殻:K殻⇒L殻⇒M殻⇒N殻…(以降アルファベット順)/箱=大文字
原子軌道:s軌道⇒p軌道⇒d軌道⇒f軌道⇒g軌道…(以降アルファベット順)/収納グッズ=小文字
①のステップで、電子殻に番号(主量子数)をつけました。K殻という箱に1、L殻という箱には2という数字をつけたということですね。原子軌道でも同じことをします。K殻という箱にある収納グッズには、1、L殻という箱にある収納グッズには2といった具合です。具体的には、K殻にあるs軌道は、1s軌道、L殻にあるs軌道は2s軌道といった感じです。
電子殻の復習の際に、箱の大きさが違うので、入れる電子の個数が違うと言いました↓

原子軌道についても同じことが言えます。箱の大きさが違う=入れる収納グッズ(●●軌道)の数が違うということです↓↓
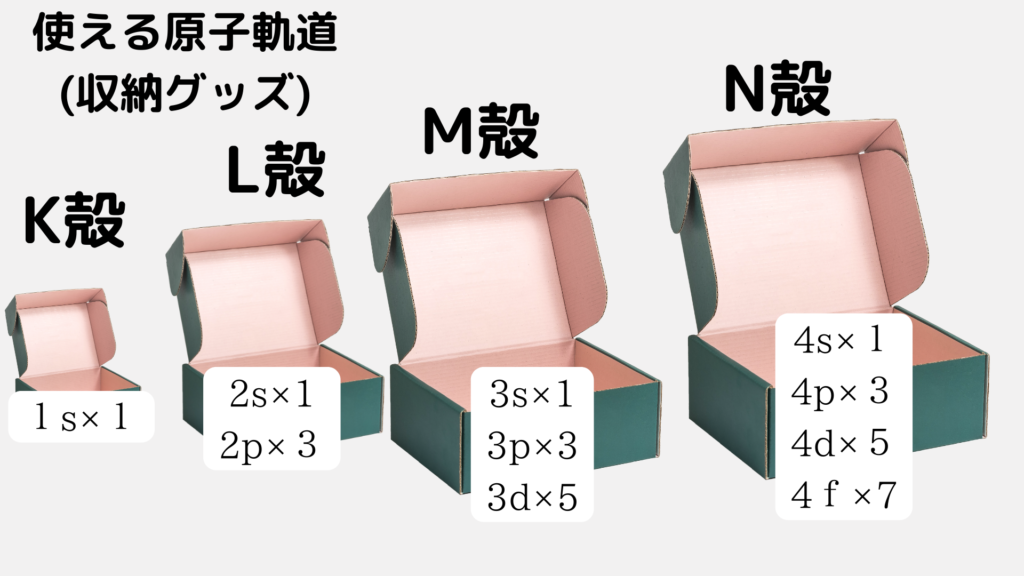
ただし、画像からわかるように、使うそれぞれ収納グッズの個数は同じです。どんな箱であってもs軌道という収納グッズは1個しか使えませんし、p軌道という収納グッズは3個しか使えません。
ここで、超重要ルールがあります。収納グッズの数についてです↓↓
軌道の数はそれぞれ奇数個で、増えていく(1個、3個、5個…)。
上の画像のように、s軌道は1個、p軌道は3個、d軌道は5個という具合に、軌道の数は必ず奇数で、軌道が大きくなるたびに増えていきます。
どんな軌道であっても、電子は2個しか収納することができません。ここで、問題です。
問題1:s軌道には何個まで電子が収納できるか?
⇒2個
問題2:p軌道には何個まで電子が収納できるか?
⇒6個
どんな軌道であっても電子が2個しか収納することができないのに、6個です。なぜでしょうか?
ヒントは先ほどの画像です↓↓
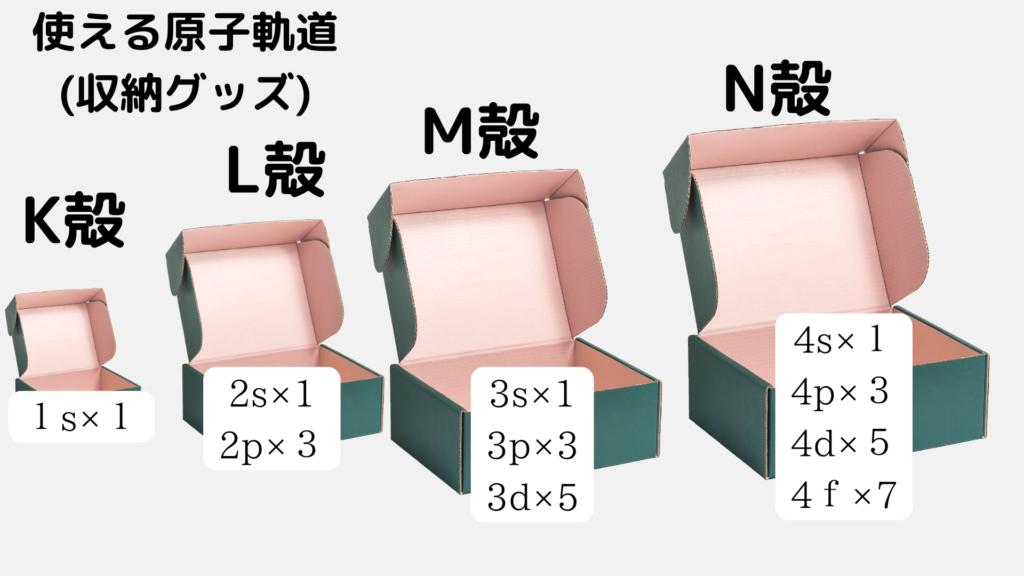
もうわかりますね。s軌道という収納グッズは絶対に1つしか使えないので2個です。それに対し、p軌道という収納グッズは3つ使うことができます。1つの軌道につき2個の電子が収納できて、p軌道は3つあるということは、2×3で6個の電子を収納することが出来ます。同様にして、d軌道は10個、f軌道は14個の電子を収納することが出来ます。
軌道の形(S軌道とP軌道)
ここで、よく出題されるs軌道とp軌道の形について考えてみましょう。収納グッズによって形が違うのは当然のことですので、s軌道とp軌道は形が違います。また、p軌道に関しては、方向によって同じ形ですが、3つに分けられます。
s軌道:球対称の形
よく勘違いしている人が多いですが、上の画像の球のふちの部分に電子が存在するわけではありません。球内であれば、どこにでも電子は存在することができます
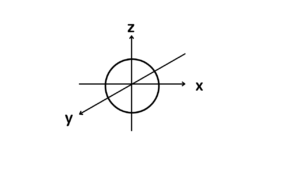
p軌道:x,y,z方向で3パターンある

全く同じ形で3方向に分かれます。それぞれの軸に注目して、その軸上のp軌道のことをそれぞれpx,py,pzというときもあります。
ここまでのまとめ
電子殻と原子軌道について、視覚的にわかりやすくまとめます。
主量子数
電子殻
原子軌道(軌道×個数)
1
K殻
1s×1
2
L殻
2s×1,2p×3
3
M殻
3s×1,3p×3,3d×5
4
N殻
4s×1,4p×3,4d×5,4f×7
5
O殻
5s×1,5p×3,5d×5,5f×7,5g×9
上記の対応関係が、きちんと説明することができれば、今回の記事の内容について充分に理解することができています。理解が充分でいないときは、解説に戻って、理解を深めましょう。
大学での勉強は、高校で雑に学習したことを丁寧に補正していきます。そのため、高校までの学習を確実に理解することから始まります。これからも頑張りましょう。
あなたの大学での理系の苦しみが少しでも和らぐことを願って…




コメント