今回の記事では、電子配置を決める3つのルール「構成原理」、「パウリの排他原理」、「フントの規則」について簡単に説明していきます。
この記事を読んで、以下の問題が解ければOKです↓↓
(1)構成原理に従って、₃₆Krの電子配置を書け。
(2)構成原理に従って、₂₆Feの電子配置をスピンを用いて書け
今は、構成原理についてもスピンについても詳しく知らないので、解けなくて全然大丈夫です。これから丁寧に説明していきます。それでは頑張っていきましょう。
※電子配置の理解には構成原理、パウリの排他原理、フントの規則の3つそれぞれの理解が絶対に必要です。1つ1つ説明していくので、飛ばさずに読み進めることをすすめます。どれか1つの理解をおろそかにすると、電子配置は解くことができませんので、素直に1から見ていきましょう。
また、そもそもの軌道の理解ができていない人は先に以下のサイトを見ることをおすすめします↓↓
ルール1:構成原理
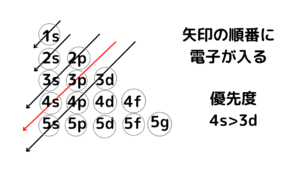
まずは、結論!構成原理と言われたら、必ず書く図↓↓
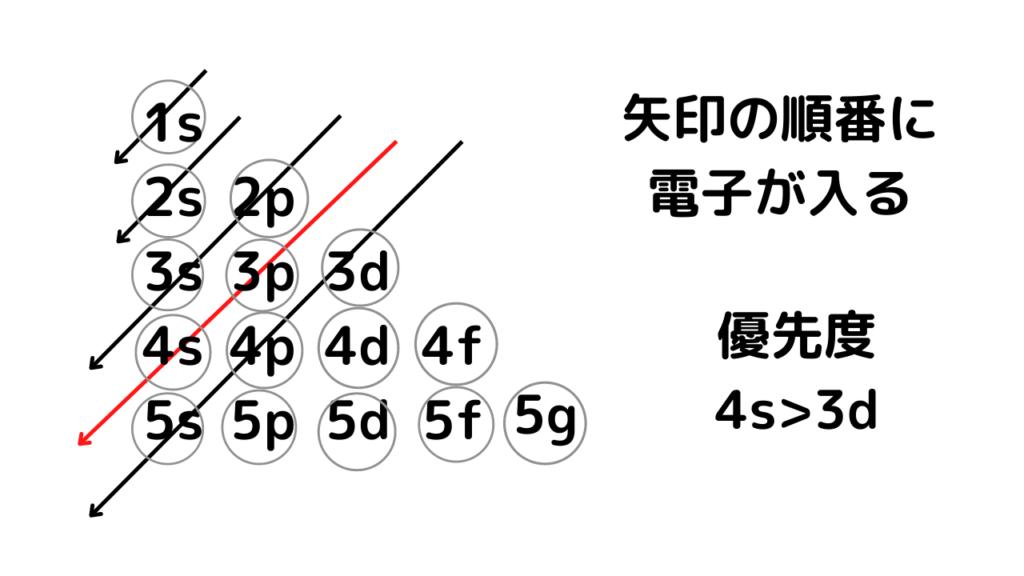
上の画像のように軌道の表を作り、斜めに矢印をひいていきます。ひいた矢印の順番で電子が入っていきます。赤矢印に着目すると、今までは、数字の大小(1s⇒2s)通り、軌道の順番(1s⇒2s⇒2p⇒3s)通りの綺麗な入り方だったのに対し、3d軌道に入る前に、次の4s軌道に入っています。上の画像を書くことで、電子の入り方が間違えないようにできるので、必ず上の画像のように書いてください。
「構成原理に従い」とあったら、上の画像を必ず書くこと
⇒1s,2s,2p,3s,3p,4s,3d,4p,5s…といった順番で電子が入っていく
※電子が入っていることの表記方法
ここで、軌道内に電子が入っている状態の表記方法を教えます。例えば、1s軌道に2個、2s軌道に2個、2p軌道に3個の電子が入っている状態を表現するには、以下のようにします。
1s² 2s² 2p³
上記のように、軌道のアルファベットの肩に入っている電子数を表記します。
軌道のアルファベットの肩に入っている電子数
そもそも構成原理とは何?という人に向けて、一応定義を述べておきます。↓↓
構成原理とは、基底状態にある原子の電子配置を決める規則の一つ。エネルギー準位の低い電子軌道から順に電子が入っていく、というもの。( goo辞書より)
構成原理の解説は以上です。とりあえず、電子が入る順番を視覚的にわかりやすくしてくれる上の画像を必ず書くことを覚えておいてください。
ルール2:パウリの排他原理
まずは、結論からどうぞ!パウリの排他原理を簡単に説明するとこうです↓↓
①1本の原子軌道には、「スピン量子数の異なる」電子が2個入る
②電子配置の表記方法を定めているもの
電子のスピン量子数は、「-1/2」と「1/2」で表すことができます。この段階で、1/2などと言った数字に特に意味はなく、2つの値が異なっているということが重要です。
この異なっているということを、電子を上向き矢印(↑)と下向き矢印(↓)で書くことで表現します。
つまり、原子軌道には、↑と↓というスピン量子数の異なる電子が2個入っています。
①のから、電子は↑と↓によって表せることがわかりました。そのため、これから電子配置を表記するときに電子の代わりに、2つの矢印を使って表します。ここで、₂Heの電子配置の表記方法について考えてみましょう。₂Heは、1s軌道(k殻)に2つの電子を持っています。
下の画像のように、まずは軌道を「〇」または「ー」で、表します。何軌道なのかを明確にするため、〇は上に、ーは横に軌道名を書きます。そして、中にそれぞれ必要な電子数を表記します。
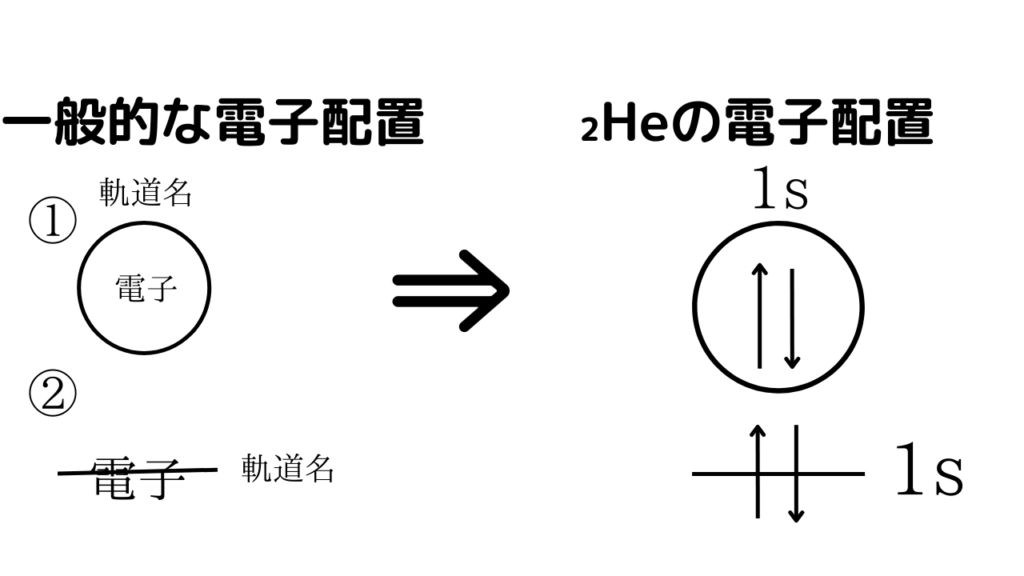
₂Heの電子の個数は2個ですので、パウリの排他原理(1本の原子軌道には、「スピン量子数の異なる」電子が2個入る)に基づいて、1s軌道の中に、2個の向きが異なる電子(矢印)を書ければOKです。
パウリの排他原理の説明は以上です。
ルール3:フントの規則
まずは結論からどうぞ。フントの規則を簡単に説明すると…↓↓
複数本の軌道があるときは、電子はできるだけ別々の軌道にスピンの向きをそろえて入っていく
「複数本の軌道」というのは、p軌道やd軌道といったs軌道より大きな軌道のことですね。s軌道は1個しかありませんが、p軌道は3個(複数)、d軌道は5個(複数)ありますから。
「スピンの向きをそろえて」については、パウリの排他原理における電子の表記方法↑と↓をどちらかの向きにそろえてということですね。ここでは、↑にそろえていきます。
では、p軌道を含む₇Nについて考えてやってみましょう!
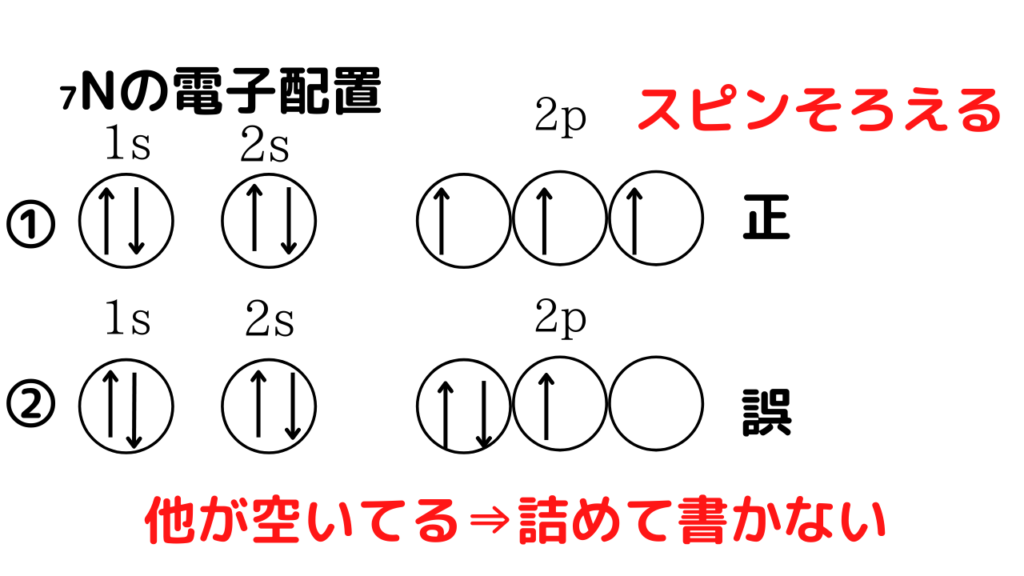
1s軌道、2s軌道は1個しかないので、そのまま電子を入れていきます(4個の電子が入る)。窒素の電子数は7個なので、残り3個をp軌道に入れていきます。ここで、p軌道は3つ(複数本)あるので、フントの規則に従う必要があります。電子はなるべく別々の軌道に、スピンの向きを揃えて書きます。電子が3個で、p軌道は3つあるので、それぞれの軌道に1個ずつ電子が入れば良いので、画像の①のような窒素の正しい電子配置なります。画像②では、p軌道に確かに3個の電子を入れていますが、軌道が1つ空席です。そのため、間違った電子配置となっています。
イメージとしては、レストランの相席を考えてみてください。テーブルが1個しかない(s軌道)場合は、相席でも仕方ありませんが、テーブルが3個ある場合(p軌道)に、他のテーブルにまだ、座れる余地があるのに詰めては座りませんよね笑(気まずい)
フントの規則の解説は以上になります。
簡略できる電子と軌道
問題を解く前に、電子と軌道をより簡単に書く方法について教えます。先に結論から↓↓
[He]や[Ne],[Ar]と書くことで、そこまでは[]内の希ガスと同じという意味になる。
₇Nと₈Oについて考えると、両者は最後のp軌道に電子が1個多いか少ないかの違いしかありません
つまり、1s,2s軌道までは全く同じなのです。
ここで希ガスである₂Heについても考えると、1s軌道が電子2個で満たされています。
よって、₇Nと₈Oの1s軌道の状態は、₂Heと同じであると言えます。
そこで、₇Nと₈Oはこのように書くことができます↓↓
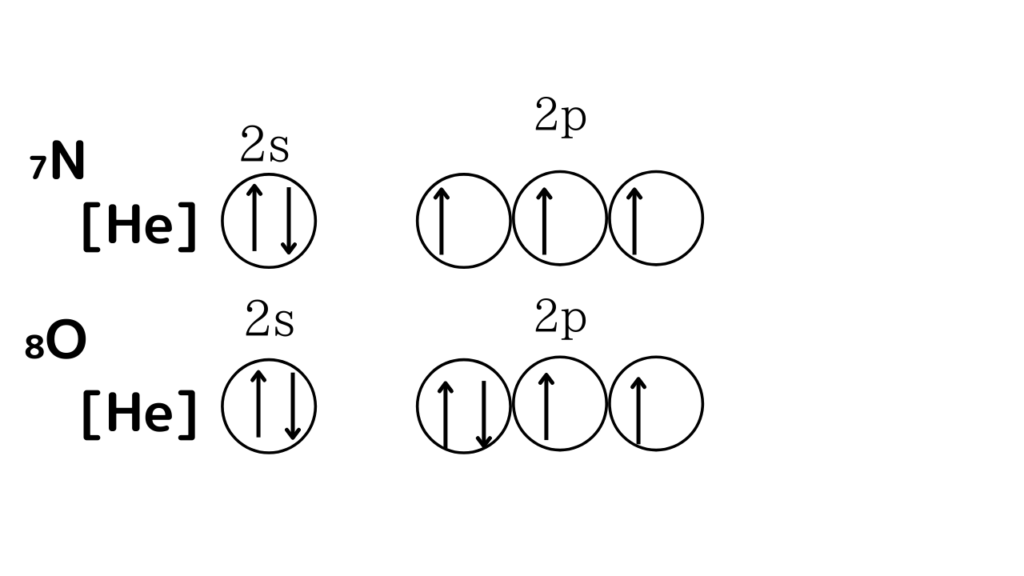
[He]くらいでは、ありがたみを感じることができませんが、[Ne],[Ar]だと感謝してもしきれなくらい書くのが楽になります。[Ne]であれば、1s,2s,2pまで書く必要がありませんし、[Ar]であれば、1s,2s,2p,3s,3pまで書く必要がありません。全部書いてしまっても間違いではないですが、楽できるのであれば、とことん楽をしましょう!
最初の問題を解いてみよう
では、全ての解説が終わったところで、一番最初の問題を解いてみましょう!
(1)構成原理に従って、₃₆Krの電子配置を書け。
(2)構成原理に従って、₂₆Feの電子配置をスピンを用いて書け
(1)構成原理に従って、₃₆Krの電子配置を書け。
<解説>
①「構成原理に従って」⇒あの図を書きましょう
1s⇒2s⇒2p⇒3s⇒3p⇒3d⇒4s…の順番で入っていきます。
②軌道1つにつき電子は2個まで入ることができるから、
s軌道(1つ)は「2個×1つ」で2個まで、p軌道(3つ)は「2個×3つ」で6個まで、d軌道(5つ)は「2個×5つ」で10個までです。
③1s² 2s² 2p⁶…みたいに表記すればいいので、肩の合計が36になるまで電子を入れていきます
軌道のアルファベットの肩に入っている電子数
⇒1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶
確かに、軌道の肩の数字の和が、2+2+6+2+6+2+10+6=36になっているので、₃₆Krの電子配置を正しく書くことができました。
(2)構成原理に従って、₂₆Feの電子配置をスピンを用いて書け
<解説>
①「構成原理に従って…」あの図を書きましょう⇒(1)で書いたので省略
②Feが電子26個あることに絶望しましょう。スピン(矢印)を26本書く必要がありますね?
否!希ガスの電子配置で楽をすることを考えましょう。₁₈Ar < ₂₆Fe <₃₆Krなので、[Ar]が使えそうですね。電子18個までは[Ar]がカバーしてくれます⇒あと8本書いたら終了
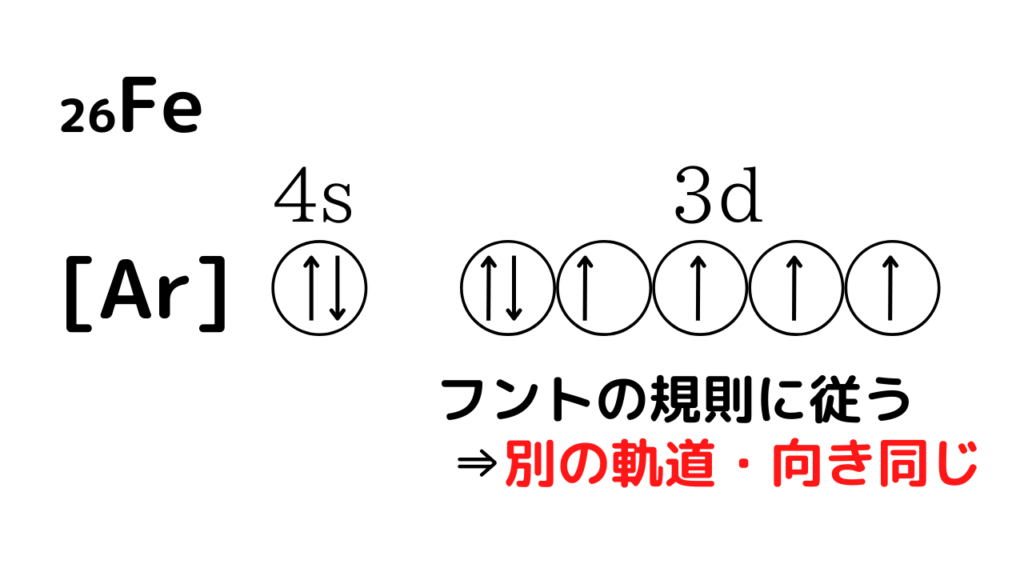
上の画像にあるように、d軌道は複数本の軌道があるので、フントの規則に従うことを忘れないでください。よって、電子(スピン)はなるべく別の軌道に、向きをそろえて入れていきます。(終了)
以上で、電子配置を決める3つのルール:構成原理、パウリの排他原理、フントの規則についての解説を終わります。この3つのルールは電子配置を考えるうえで、絶対に覚えておく必要があるので、何回も見直しましょう。
あなたの大学での理系の苦しみが少しでも和らぐことを願って…




コメント
コメント失礼します。ページに掲載されている画像をレポートに使用してもよいですか?