今回の記事では、大学化学で学ぶ「イオンの活量」について解説します。特に活量の考え方をしっかり学びましょう。
この記事を読んで以下のことを理解できればOKです↓↓
①イオン間の相互作用から活量の大小を説明ができる
②イオン強度の計算ができる
今は、なんのこっちゃで大丈夫です。丁寧に説明していきます。
イオンの活量
まずは結論。イオンの活量は次の式で定義されます↓
活量ai = fi×Ci
※fi=i成分の活量係数、Ci:=i成分のモル濃度
活量(activityの頭文字)aは、イオンがどのくらい水溶液中で動き回るかというイオンの活動度を表しています。動き回るイオン=水溶液中にイオンが有効なものとして存在するということですから、活量a=イオンの有効濃度とも言っていいです。
電解質ApBqの活量係数について
まずは結論。電解質ApBqでの活量係数は次のように定義されています。
活量係数f(±) = (f+^n × f-^m)^(1/n+m)
※f(±)の±は陽イオンと陰イオンの意味
入力の関係上、少し複雑な式に見えますが、次の例を見れば、簡単にわかります↓

画像のようにApBqを、例えば、CaCl₂に当てはめてみれば、簡単にわかると思います。
また、電解質ApBqの活量係数の式で、p=1,q=1のときに、特別な式のように
f(±)=√(f₊×f₋ )
という式が書かれることが多いですが、
単純に上の画像の式を見れば、導けることなので、わざわざ個別に覚える必要はありません。
活量係数f±が以上のように、定義できたので、電解質ApBqの活量aは次のようになります。
活量a± = f(±)×[ApBq]
※Ci=i成分のモル濃度=電解質ApBqのモル濃度=[ApBq]
【超重要】活量の大小の考え方
記述問題としてよく出る活量を考える上で重要なのが次の図です↓↓
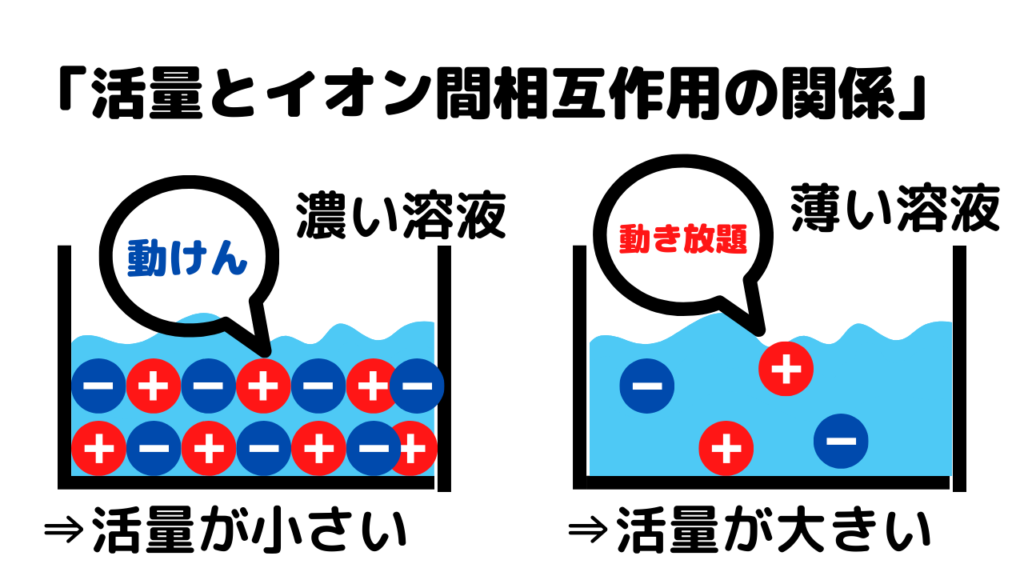
上の画像のように、濃い溶液では、イオンがたくさんあるため、イオン間の相互作用が非常に強くなります。つまり、イオンそれぞれがきつきつな状態になります。この状態では、各イオンが溶液中を動きまわることができません。活量の考え方は、「イオンがどのくらい水溶液中で動き回るかというイオンの活動度」ですので、濃い溶液の活量はとても小さいということになります。一方、薄い溶液では、イオンが少ししかありません。よって、イオン間の相互作用は弱く、イオンはすんなりと動き回ることができるため、薄い溶液の活量は大きいのです。
※活量a=イオンの有効濃度ですから、イオンがたくさんあるほうが、活量が大きいと考えがちですが、少ないほうが、動きまわるイオンは、多いということを覚えておきましょう。
濃い溶液と薄い溶液では活量はどちらが大きいか、理由もつけて説明せよ
上の解説から自分で考えてみましょう。
以上です。誤りがあればコメント指摘していただけると幸いです。修正します。




コメント