今回の記事では、高校化学で頻出の「ルシャトリエの原理」について解説します。めちゃめちゃ大事です。絶対ここで確実に理解できるようにしましょう。最後に問題演習があるので、解くことができるかチェックしましょう!!
この記事を読んで、以下のことを理解できればOKです↓↓
・ルシャトリエの原理は天邪鬼な法則
・ルシャトリエの外的要因は、濃度・温度・圧力
上記のことを念頭に入れて、さっそくやっていきましょう。
ルシャトリエの原理とは
まずは結論。ルシャトリエの原理とは、以下の定義です↓↓
平衡が成立している時、条件を変えると、条件変化による影響を緩和する方向に平衡が移動する
ここでいう条件変化とは、「濃度」、「圧力」、「温度」の3つのことを指します。
ここで、重要なことは、変化の影響のみを考えて、それに伴う影響は考えなくて良いということです。
ルシャトリエの原理は天邪鬼。
ここが一番大事です!ルシャトリエの原理の根幹部分なので、しっかり聞いてください。
ルシャトリエの原理はとにかく天邪鬼なんです。まずは結論を↓↓
増やすと減少する方向へ、減らすと増加する方向へ平衡が移動する
加圧すると減圧する方向へ、減圧すると加圧する方向へ平衡が移動する
発熱すると吸熱する方向へ、吸熱すると発熱する方向へ平衡が移動する
天邪鬼とは反対のことしか言わない妖怪のことです。上の条件変化と平衡の移動方向を見ると、
完全に反対ということがわかりますね。増えたら下がるし、下げたら上がります。
このように、ルシャトリエの原理は天邪鬼なんです。
ルシャトリエの原理の定義から、「条件変化による影響を緩和する方向に平衡が移動すること」とありました。緩和する=変化を0にするということです。
例えば、濃度が0の状態から+1になった場合、緩和する(変化を0にする)には、-1をすれば良いわけです。+1だったら、-1をする=増えたら下げる全く同じです。
ここまで、わかれば、あとはひたすら問題演習ですよ!行ってみましょう↓↓
問題演習
各問題の反応それぞれが平衡状態にあり、それぞれに対して【】内のある操作を行った。この時平衡はどちらに移動するか。「右」「左」「移動しない」で答えよ。
平衡の移動は、反応式における「右」、「左」、「移動しない」で答えることが多いです。
「条件変化⇒天邪鬼⇒緩和」の順番で解いていけば大丈夫です。
N₂(気)+3H₂(気)⇄2NH₃(気)+Q 【アンモニアを一部取り除く(減らす)】
アンモニアを減らす⇒天邪鬼⇒アンモニアを増やす方向に進む
よって右に平衡は進む
2NO(気)⇄N₂(気)+O₂(気)+Q 【圧力一定で、加熱する】
加熱する⇒天邪鬼⇒熱が減らす方向に進む
熱が減らす方向?ってなるけど、要するにQが消える=熱がなくなる
よって左に平衡が進む
C₂H₄(気)+H₂(気)⇄C₂H₆(気)+Q 【温度一定で、加圧する】
加圧する⇒天邪鬼⇒減圧する方向へ進む
※圧力の増減は係数で考える
左辺の係数の合計2、右辺の係数の合計1であるのは一目でわかる
ここで、係数大→係数小が、減らす方向。係数小→係数大が増やす方向
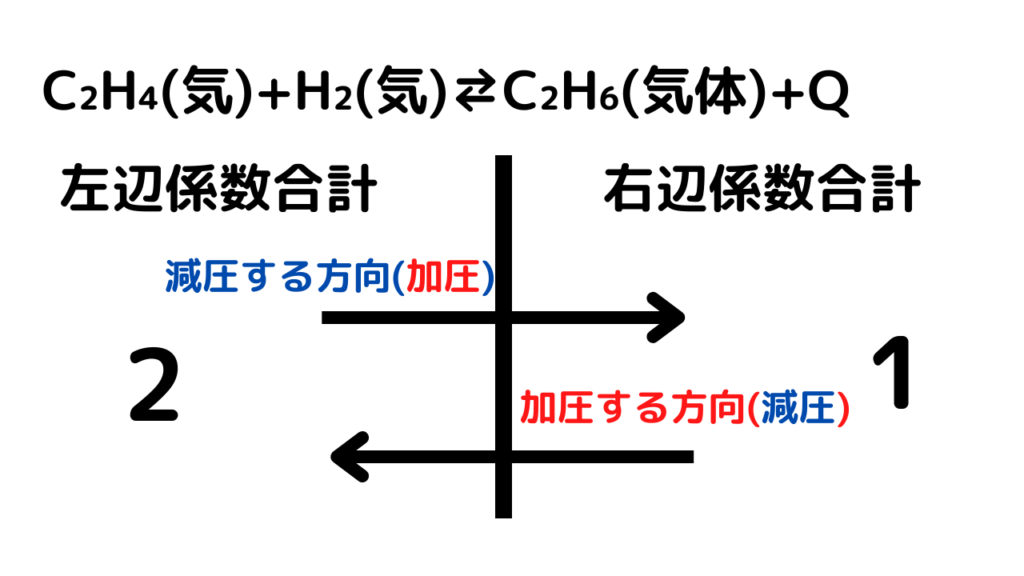
よって減らす方向に進めばいいので、平衡は右に進む
2HI(気)⇄H₂(気)+I₂(気)ーQ 【温度一定で、減圧する】
減圧する⇒天邪鬼⇒加圧する方向へ
左辺の係数の合計2、右辺の係数の合計2 両辺とも合計が等しい
よって平衡は移動しない
2NO₂(気)⇄N₂O₄(気)+Q 【温度一定で、容器の体積を大きくする】
気体の状態方程式を考えると、PV=nRT
温度一定より、右辺は定数であるため、容積Vを大きくすると、圧力は減らなければならない
減圧する⇒天邪鬼⇒加圧する方向へ
左辺の係数の合計2、右辺の係数の合計1
係数小→係数大が加圧する方向なので、平衡は左に進む
2SO₂(気)+O₂(気)⇄2SO₃(気)+Q 【触媒を加える】
外的要因は濃度、圧力、温度であり、触媒は関係がない
よって平衡は移動しない
CH₃COOH+H₂O⇄H₃O(+)+CH₃COO(ー) 【酢酸ナトリウムを加える】
酢酸ナトリウムは電離するNa(CH₃COO)→CH₃COO(ー)+Na(+)
つまり、酢酸イオンの濃度が増加すると考えられる
酢酸イオンが増加する方向へ⇒天邪鬼⇒酢酸イオンが減少する方向へ
よって平衡は左に移動する
CH₃COOH+H₂O⇄H₃O(+)+CH₃COO(ー) 【水を加える】
水を増やす方向へ⇒天邪鬼⇒水を減らす方向へ
よって平衡は右に移動する
問題演習は以上となります。
ということでルシャトリエ=天邪鬼はわかってもらえればうれしいです。
ぶっちゃけこの記事の問題演習をやれば、ルシャトリエの原理は完璧です。
誤りがあれば、コメント指摘していただけると幸いです。修正します。




コメント